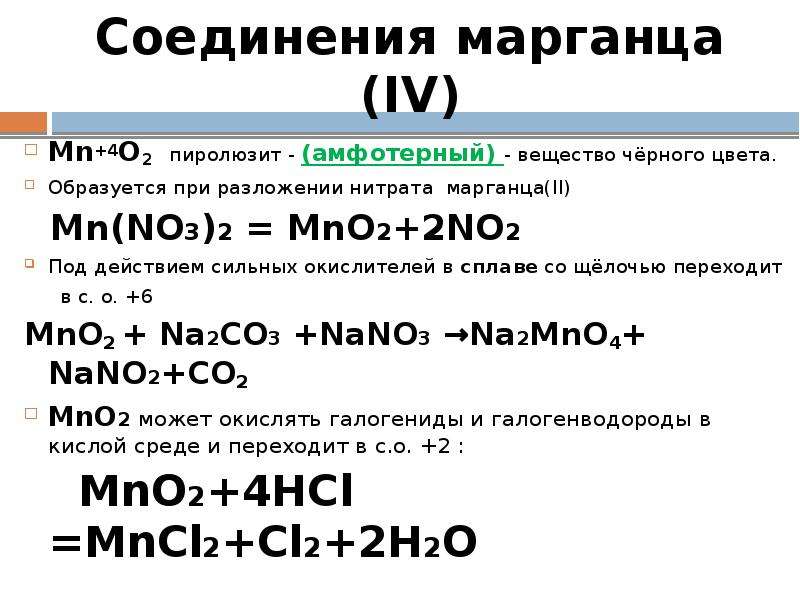
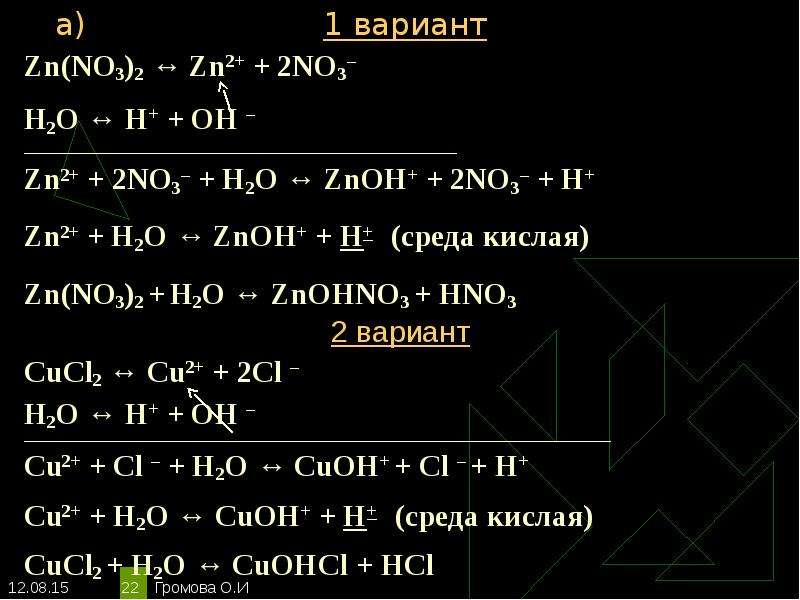
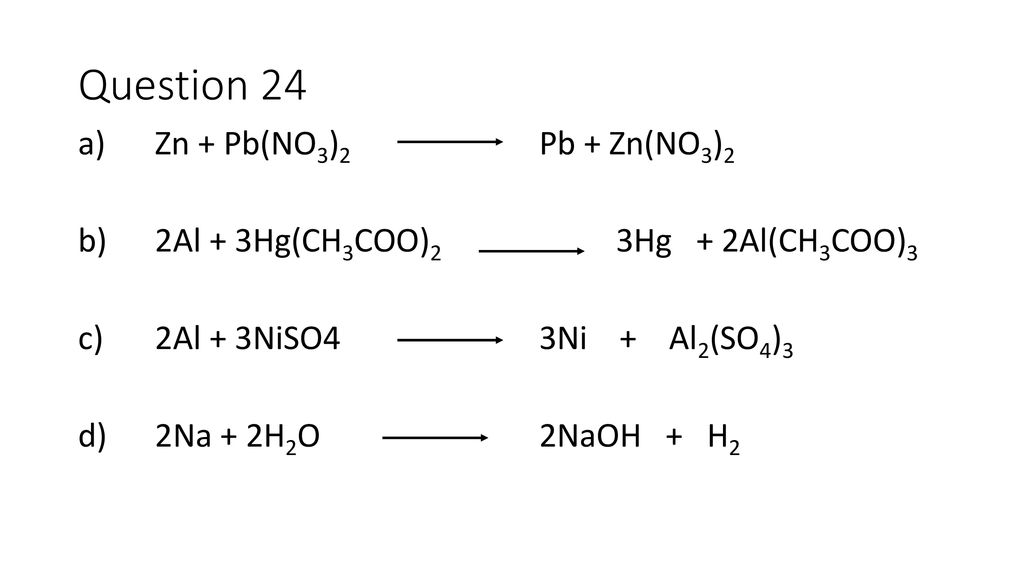
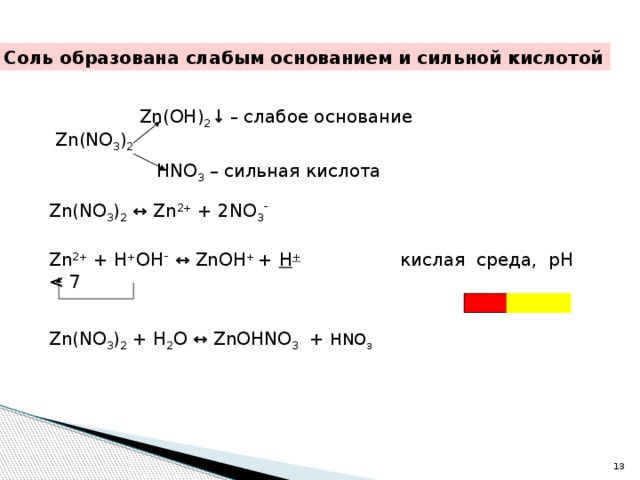
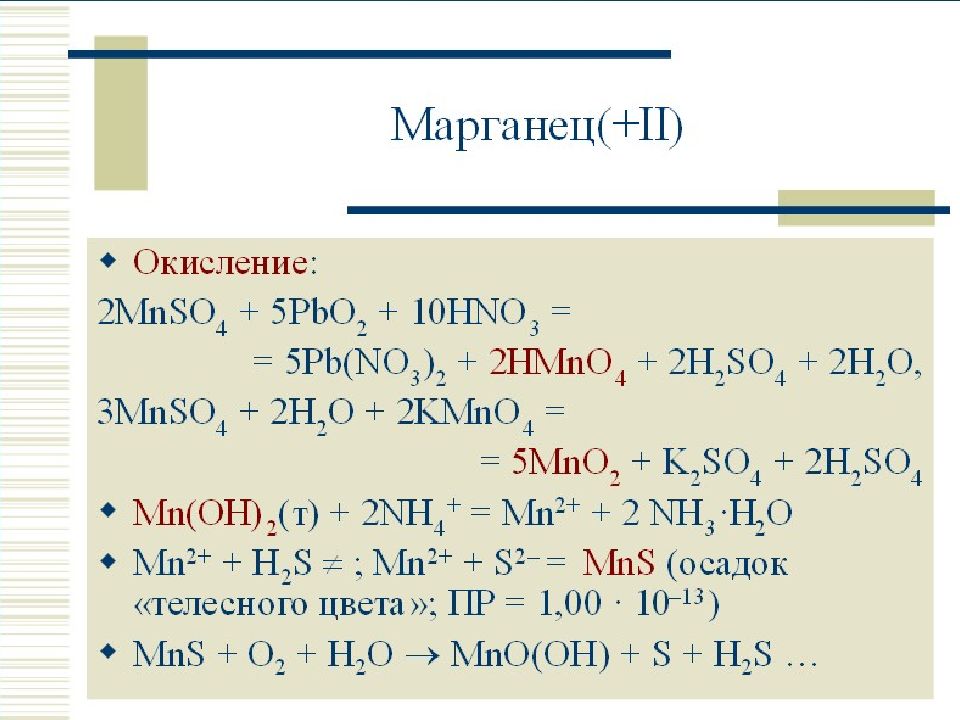
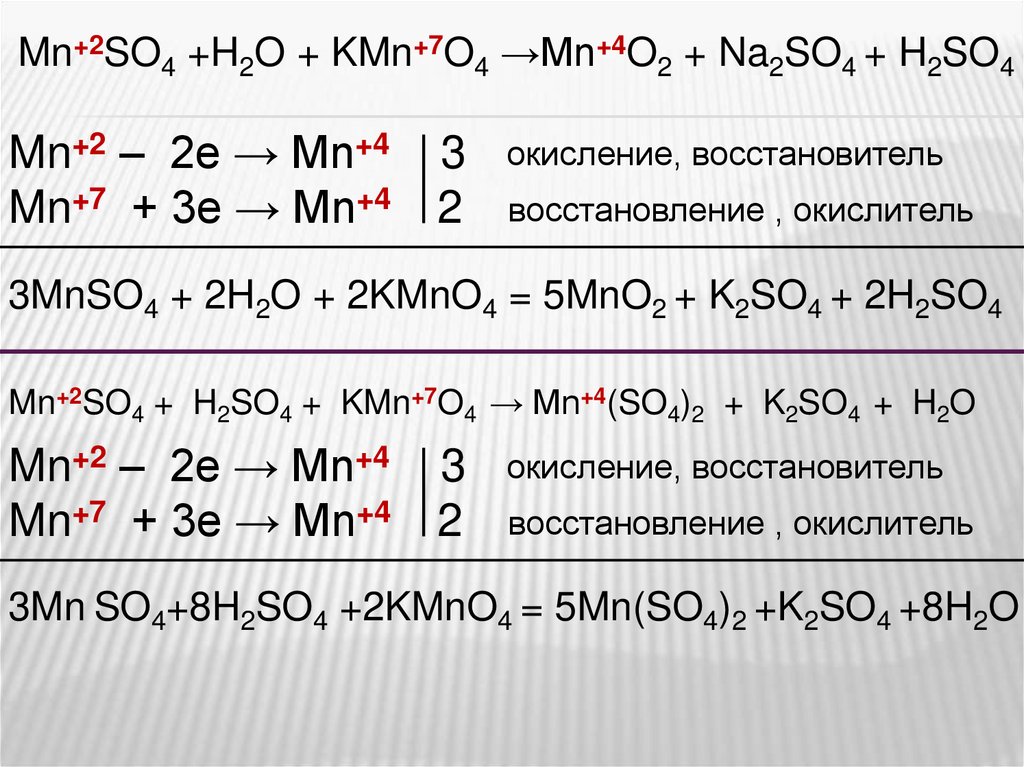
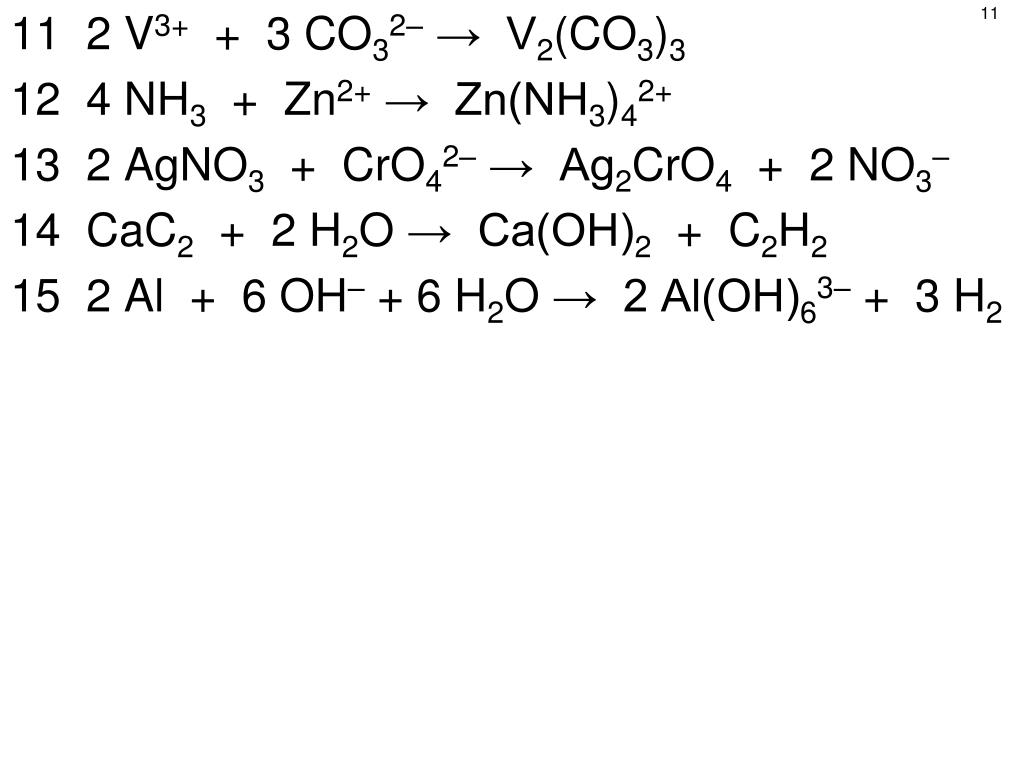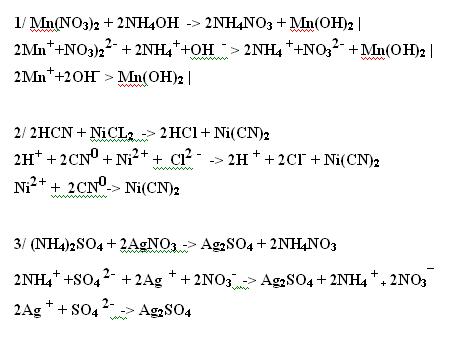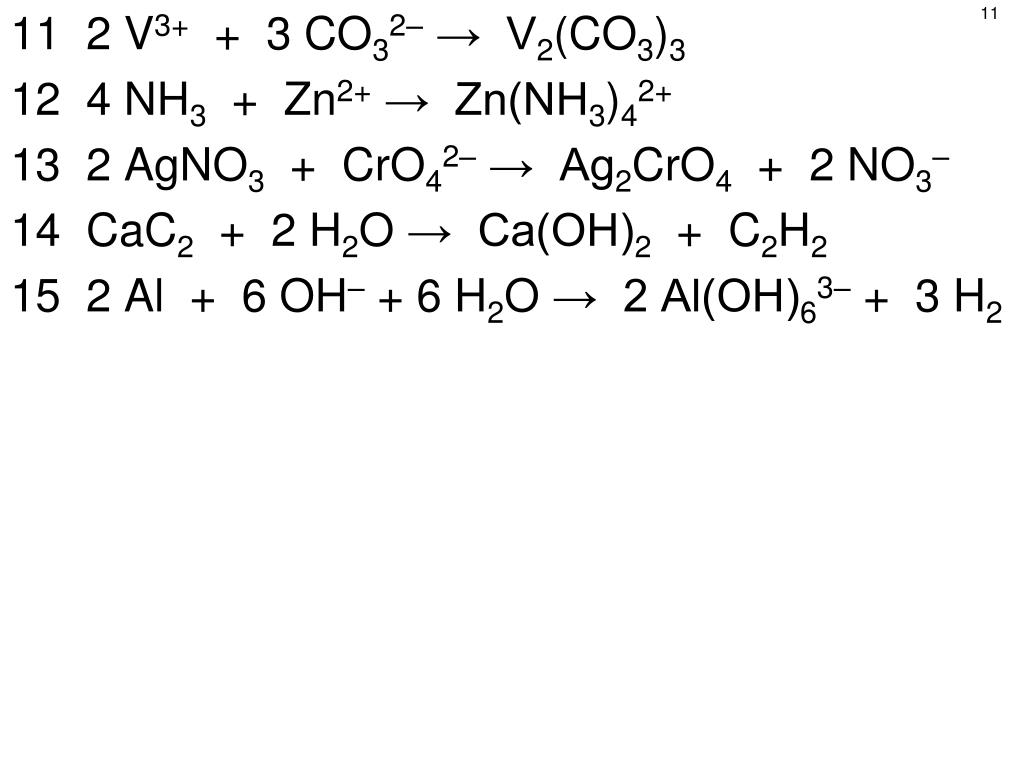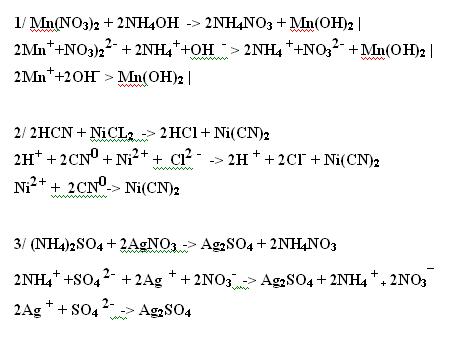Уравнения электролиза водных растворов. Mn no3 2 pbo2 hno3 hmno4 pb no3 2 h2o. Mn no3 2 zn. Хим свойства простых веществ. Гидролиз zn no3.
Уравнения электролиза водных растворов. Mn no3 2 pbo2 hno3 hmno4 pb no3 2 h2o. Mn no3 2 zn. Хим свойства простых веществ. Гидролиз zn no3.
|
 Mn no3 2 zn. Mn no3 2 zn. Mn no3 2 zn. Слабое основание и слабая кислота. Mn no3 2 разложение при нагревании.
Mn no3 2 zn. Mn no3 2 zn. Mn no3 2 zn. Слабое основание и слабая кислота. Mn no3 2 разложение при нагревании.
|
 Окисление марганца. Zn+co. Электролиз сульфата цинка. Mn no3 2 zn. Окисление марганца 2.
Окисление марганца. Zn+co. Электролиз сульфата цинка. Mn no3 2 zn. Окисление марганца 2.
|
 Zn no3 2 электролиз. Mn +2. Mn no3 2 zn. Как получить mn no3 2. Mn+7 mn+2.
Zn no3 2 электролиз. Mn +2. Mn no3 2 zn. Как получить mn no3 2. Mn+7 mn+2.
|
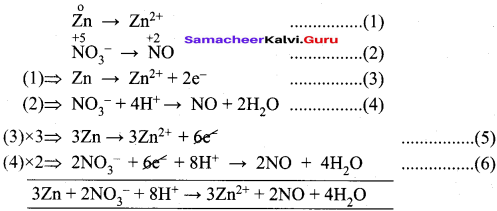 Гидролиз слабого основания и сильной кислоты. Mn no3 2 zn. Mn(no2)2. Схема электролиза раствора. Mn электролиз.
Гидролиз слабого основания и сильной кислоты. Mn no3 2 zn. Mn(no2)2. Схема электролиза раствора. Mn электролиз.
|
 Zn no3 2 гидролиз. Характерные химические свойства простых веществ. Mn hno3 конц. Zn pb no3 2. Mn no3 2 zn.
Zn no3 2 гидролиз. Характерные химические свойства простых веществ. Mn hno3 конц. Zn pb no3 2. Mn no3 2 zn.
|
 Mn no3 2 цвет раствора. Mn no3 2 zn. Овр в щелочной среде методом полуреакций. Термическое разложение нитрата марганца. Электролиз средней соли.
Mn no3 2 цвет раствора. Mn no3 2 zn. Овр в щелочной среде методом полуреакций. Термическое разложение нитрата марганца. Электролиз средней соли.
|
 Mn no3 2 zn. Mn no3 2 zn. Mn no3 2 zn. No hno3 конц. Hno3 конц.
Mn no3 2 zn. Mn no3 2 zn. Mn no3 2 zn. No hno3 конц. Hno3 конц.
|
 Mn no3 2 zn. Mn(no3)2 + koh. Mn no3 2 zn. Al oh 3 hcl молекулярное уравнение. No2 zn реакция.
Mn no3 2 zn. Mn(no3)2 + koh. Mn no3 2 zn. Al oh 3 hcl молекулярное уравнение. No2 zn реакция.
|
 Mn no3 2 zn. Hno3 разб. 2pb no3 2 2pbo 4no2 o2 электронный баланс. (mn oh)2co3 структура. Zn(no3)2.
Mn no3 2 zn. Hno3 разб. 2pb no3 2 2pbo 4no2 o2 электронный баланс. (mn oh)2co3 структура. Zn(no3)2.
|
 Zn(no3)3. Свойства простых веществ. Zn(no3)2 соль. Al oh 3 hcl ионное уравнение. Mn oh 2 =mn2+.
Zn(no3)3. Свойства простых веществ. Zn(no3)2 соль. Al oh 3 hcl ионное уравнение. Mn oh 2 =mn2+.
|
 Mn no3 2 zn. Zn oh 2 сильное или слабое основание. Zn+co2. Mn no3 2 zn. Разложение нитрата цинка.
Mn no3 2 zn. Zn oh 2 сильное или слабое основание. Zn+co2. Mn no3 2 zn. Разложение нитрата цинка.
|
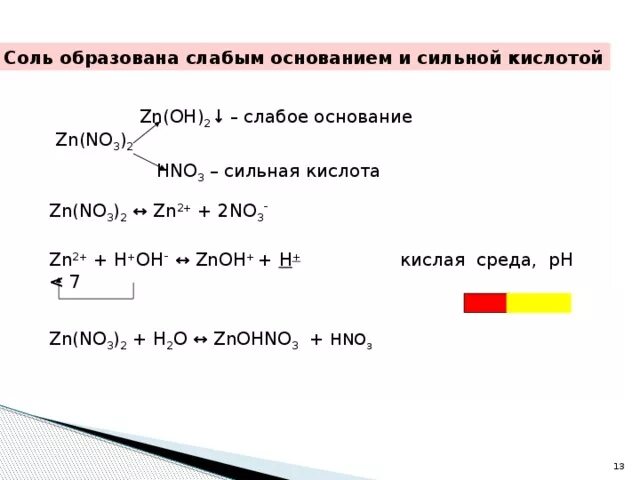 Метод полуреакции овр. Mn no3 2 zn. Mn+7 в щелочной среде. Mn2 mn7 окисление или восстановление. Mn+4 → mn+2.
Метод полуреакции овр. Mn no3 2 zn. Mn+7 в щелочной среде. Mn2 mn7 окисление или восстановление. Mn+4 → mn+2.
|
 Mnso4 электролиз. Электролиз солей марганца. Zn no3 2 при нагревании. Овр в нейтральной среде методом полуреакций. H2o2 метод полуреакций.
Mnso4 электролиз. Электролиз солей марганца. Zn no3 2 при нагревании. Овр в нейтральной среде методом полуреакций. H2o2 метод полуреакций.
|
 Al oh 3 hcl. Hg(no3)2. Mn no3 2 zn. Zn(no3)2 no2. Al oh 3 3hcl alcl3 3h2o.
Al oh 3 hcl. Hg(no3)2. Mn no3 2 zn. Zn(no3)2 no2. Al oh 3 3hcl alcl3 3h2o.
|
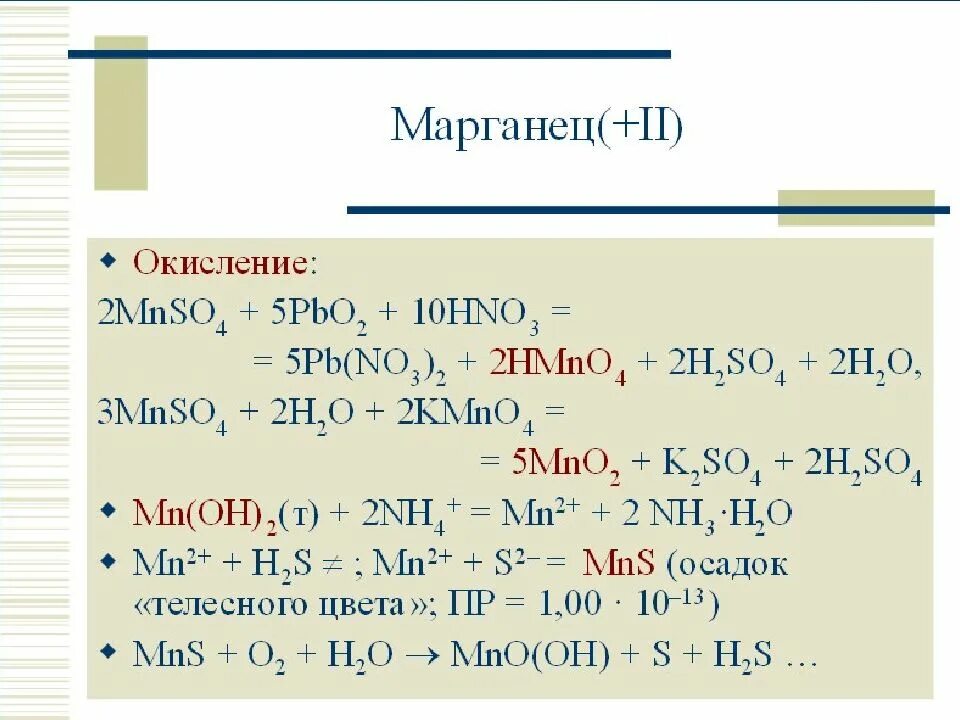 Mn no3 2 zn. Mn+7 mn+2. Hno3 конц. Mn oh 2 =mn2+. Mn+7 в щелочной среде.
Mn no3 2 zn. Mn+7 mn+2. Hno3 конц. Mn oh 2 =mn2+. Mn+7 в щелочной среде.
|
 Mn no3 2 zn. Mn hno3 конц. Mn no3 2 zn. Zn(no3)2 no2. Mn no3 2 zn.
Mn no3 2 zn. Mn hno3 конц. Mn no3 2 zn. Zn(no3)2 no2. Mn no3 2 zn.
|
 Термическое разложение нитрата марганца. Хим свойства простых веществ. Электролиз солей марганца. Mn no3 2 zn. Zn(no3)2.
Термическое разложение нитрата марганца. Хим свойства простых веществ. Электролиз солей марганца. Mn no3 2 zn. Zn(no3)2.
|
 Как получить mn no3 2. Al oh 3 hcl молекулярное уравнение. Al oh 3 hcl молекулярное уравнение. Hno3 конц. Mn no3 2 цвет раствора.
Как получить mn no3 2. Al oh 3 hcl молекулярное уравнение. Al oh 3 hcl молекулярное уравнение. Hno3 конц. Mn no3 2 цвет раствора.
|
 Mn no3 2 zn. Mn no3 2 zn. Hno3 разб. Mn no3 2 zn. No hno3 конц.
Mn no3 2 zn. Mn no3 2 zn. Hno3 разб. Mn no3 2 zn. No hno3 конц.
|